QSR820,又称21CFR820,是美国医疗器械质量管理体系法规的英文缩写,因其位于美国lb法规(Code of Federal Regulations)第21 卷第820 部分,故名。QSR820是美国(人用)医疗器械制造商以及拟将产品销往美国的外国(人用)医疗器械制造商必须遵守的质量管理体系法规。是多数医疗器械在美国上市之前必须遵守、上市之后随时可能抽查的基本要求。这种抽查即通常所说的FDA 工厂检查。
随着我国医疗器械进入美国的数量增多,FDA 增加了对中国医疗器械企业进行质量体系检(FDA工厂检查)的力度。由于对法规不了解、不理解,有的企业曾多次被FDA提出警告、扣押或巨额罚款。
工厂检查所涉及的法规包括:
l 21 CFR part 820 质量体系法规;
l 21 CFR part 803 医疗器械报告;
l 21 CFR part 821 医疗器械追踪;
l 21 CFR part 806 纠正与移除的报告;
l 21 CFR part 807 注册与列示。
所有往美国销售医疗器械的企业都有责任理解、执行并符合这部分法规的要求。
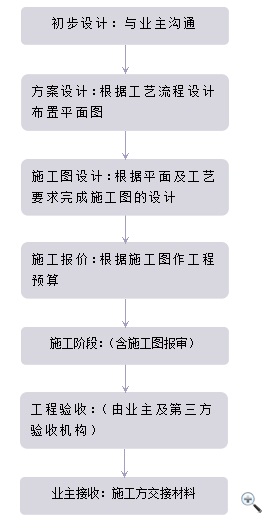
为使您的产品成功推向美国市场,弗锐达http://.机构将可帮助您建立一套完整的QSR820质量管理体系。同时还不定期提供{zx1}的QSR 820(21 CFR PART 820)法规培训、协助您建立符合21 CFR part 820要求的质量管理体系、预审服务,识别您现行体系和21 CFR part 820之间的差异、现场审核支持服务等全方位的咨询及服务。